| 央視網|中國網絡電視臺|網站地圖 |
| 客服設為首頁 |
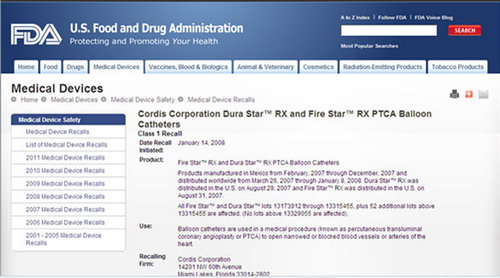
美國 FDA網站上將“Dura Star” 和 “Fire Star”球囊導管召回事件定為最嚴重的“一級召回”。
中國網7月13日訊(記者 劉永曉 馬藝文)7月12日,跨國制藥企業強生公司再次出現召回事件:由於可能會出現“緩慢收縮”或“無法收縮”的問題,強生宣佈召回Cordis公司生産的球囊擴張導管(商品Fire Star),涉及産品批號為15437344。
從國家藥監局官方微博“中國藥監”上披露的消息獲悉,宣佈召回的該款産品在中國共有118盒,其中銷售86盒,庫存32盒。
這次召回事件不同於以往數十次“和中國市場無關”的召回,這是強生公司主動在中國國內召回所屬産品。
“無法收縮”的導管手術後拔不出
球囊擴張導管,是一種在心臟介入手術中普遍應用的醫療用品。它的主要作用是用於支撐冠狀動脈的狹窄部分,來支持心臟手術的正常進行。
“基本上每一例心臟介入手術都要用到球囊擴張導管,手術之後再拔出來。”阜外心血管病醫院心血管博士後楊進剛告訴中國網財經中心記者,如果出現“緩慢收縮”或者“無法收縮”的問題,放入患者血管中的球囊導管無法拔出來,強行拔出就會造成心內膜損傷。
“本來直徑只有1mm的血管,通過球囊擴張導管支撐到3mm,如果無法收縮,拔出來的時候血管都要被撐到3mm的程度,心臟動脈就會損傷,心率發生改變,嚴重的可能會導致心梗。”楊進剛説。
但由於臨床使用比較普遍,楊進剛認為可能是這個品牌的某一批次或者某一型號的球囊擴張導管出現了問題。
2008年初曾全球召回 當年6月進入中國
此次召回的強生公司“Fire Star”球囊擴張導管,是在2008年6月獲批進入中國市場的,但該産品在2008年1月14日久被美國FDA通告“一級召回”。
中國網財經中心記者在美國食品和藥品監督管理局官方網站(http://www.fda.gov)上找到了召回的詳細信息。
在2008年1月14日的公告中,強生在美國宣佈召回“Dura Star” 和 “Fire Star”球囊導管,美國 FDA網站上將該事件定為最嚴重的“一級召回”。當年召回的原因就是“緩慢收縮”或“無法收縮”。
四年前在美國出現的同樣問題,四年後在中國再次出現。對此,中國網財經中心記者致電強生公司媒體服務部經理蔣柯時,對方否認了強生同類産品曾被FDA通告。
強生稱未使用的55盒導管産品已被管控
截稿前,中國網財經中心收到了強生公司對於此次召回的書面進展説明:強生(中國)醫療器材有限公司于6月13日完成該批次産品相關的醫院和經銷商的通知工作,並於6月18日上報上海市食品藥品監督管理局。
據悉,該批次産品的召回只涉及亞洲市場。在中國,共涉及到118盒該産品,截止到目前為止,未使用的55盒産品全部在強生(中國)醫療器材有限公司的管控之下。